Metodyka badań hydrologicznych i hydrochemicznych
1. Temperatura i zasolenie
Temperatura i zasolenie będą mierzone przy pomocy sond CTD opuszczanych z pokładu statku i pozwalających na zapis wartości temperatury i zasolenia w odniesieniu do głębokości.
2. Zawartość tlenu
Zawartość tlenu rozpuszczonego w wodzie będzie oznaczana metodą Winklera. Próby do oznaczenia rozpuszczonego tlenu będą pobierane przy pomocy czerpacza Ruttnera i/lub butli batometrycznej. Próby będą pobierane na głębokościach: 0–1; 10; 20; 30 i 40m (zależnie od rzeczywistej głębokości stacji pomiarowej). Przy głębokościach przydennych różniących się mniej niż 2,5m od założonej głębokości standardowej, zostanie pobrana tylko próba z głębokości przydennej. Natomiast przy głębokościach różniących się 2,5m oraz ponad od założonej głębokości standardowej, pobrana zostanie dodatkowa próba z warstwy przydennej. Pobór próby przydennej zostanie wykonany na głębokości około 1m nad dnem, zależnie od panujących warunków hydrometeorologicznych determinujących możliwość poboru takiej próby.
3. Przejrzystość wody
Pomiar przejrzystości wody będą wykonywane przy pomocy białego krążka Secchiego o średnicy 30 cm. Pomiary będą wykonywane z dokładnością 10 cm.
4. Zawartość biogenów w toni wodnej
W celu określenia zawartości substancji biogenicznych, próby wody pobrane będą za pomocą czerpacza Ruttnera i/lub butli batometrycznej z następujących głębokości: 0–1; 2,5; 5; 10; 15; 20; 30 i 40m (zależnie od rzeczywistej głębokości stacji pomiarowej). Przy głębokościach przydennych różniących się mniej niż 2,5m od założonej głębokości standardowej, zostanie pobrana tylko próba z głębokości przydennej. Natomiast przy głębokościach różniących się 2,5m oraz ponad od założonej głębokości standardowej, pobrana zostanie dodatkowa próba z warstwy przydennej. Pobór próby przydennej zostanie wykonany na głębokości około 1m nad dnem, zależnie od panujących warunków hydrometeorologicznych determinujących możliwość poboru takiej próby..
Woda do oznaczeń substancji biogenicznych zostanie pobrana do plastikowych butelek o pojemności 500 ml. Z racji niemożności wykonania analiz chemicznych na pokładzie jednostki pływającej, próby będą składowane w niskiej temperaturze w chłodziarkach. Analizy chemiczne wody pobranej na wszystkich poziomach dyskretnych zostaną wykonane tego samego dnia po dostarczeniu ich do laboratorium na lądzie.
Do analiz substancji biogenicznych wykorzystane zostaną standardowe metody rekomendowane dla Bałtyku przez BMP (Baltic Monitoring Program).
Oznaczane będą następujące parametry:
- Rozpuszczony fosfor nieorganiczny (P-PO4)
Metoda kolorymetryczna Koroleff’a. Fosforany zawarte w wodzie morskiej reagują z molibdenianem amonu tworząc kompleks w postaci heteropolikwasu, który jest redukowany przez kwas askorbinowy, tworząc niebieski kompleks. Pomiar absorpcji światła o długości fali 880 nm jest przeprowadzany przy użyciu spektrofotometru firmy HACH.
- Reaktywne krzemiany (Si-SiO4)
Metoda kolorymetryczna Mullin i Riley, zmodyfikowana przez Grasshoff’a, a opisana w UNESCO (1983). Niebieski, krzemowo-molibdenowy kompleks tworzy się po ok. 30 minutach od momentu dodania kwasu askorbinowego po czym następuje pomiar absorbcji światła o długości fali 810 nm (spektrofotometr firmy HACH Lange).
- Azotyny (N-NO2)
Metoda kolorymetryczna. Dodanie sulfonilamidu powoduje utworzenie związku dwuazowego, który w reakcji z dichlorowodorkiem N-(1naftylo-etyleno-diaminy) – tworzy amarantowy kompleks. Pomiar absorpcji światła o długości fali 540 nm (spektrofotometr firmy HACH Lange).
- Azotany (N-NO3)
Oznaczenie azotanów zawartych w wodzie morskiej sprowadza się zredukowania ich do azotynów. Redukcję przeprowadza się na kolumnach redukcyjnych wypełnionych granulkami kadmu pokrytego miedzią koloidalną. Pomiar absorpcji światła o długości fali 540 nm (spektrofotometr firmy HACH Lange).
- Amoniak (N-NH4)
Metoda kolorymetryczna opracowana przez Koroleff z modyfikacjami wprowadzonymi przez Carlberga. Próby wody z dodanymi odczynnikami muszą być przechowywane przez minimum 10 godzin w szklanych kolbkach stożkowych i korkiem na szlif. Pomiar absorpcji światła o długości fali 630 nm (spektrofotometr firmy HACH Lange).
- Azot całkowity (N-tot) i Fosfor całkowity. (P-tot.)
Oznaczanie azotu i fosforu całkowitego metodą równoczesnego utleniania związków azotu i fosforu przez dodanie pirosiarczanu sodu (K2S2O8), jako utleniacza (UNESCO 1983). Do oznaczeń niezbędne są butelki przeznaczone do gotowania prób przez 30 minut w autoklawie w temperaturze 110-115 oC. Do oznaczenia stężeń azotu i fosforu całkowitego stosuje się odpowiednio metody opisane powyżej dla fosforu nieorganicznego i azotanów.
Metodyka badań fitoplanktonu i zawartości chlorofilu a w wodzie
W celu określenia składu ilościowego i jakościowego fitoplanktonu oraz koncentracji chlorofilu a próby wody pobrane będą za pomocą czerpacza Ruttnera i/lub butli batometrycznej. Zgodnie z metodyką zalecaną przez HELCOM próby wody przeznaczone do analiz biologicznych (fitoplankton i chlorofil) zostaną zintegrowane w warstwie 0–10m, a tam gdzie głębokość jest większa niż 10m, pobrana będzie dodatkowa próba z warstwy 10–20m. Integracja próbek wody będzie przeprowadzona z wody pobranej na głębokościach: 0–1; 2,5; 5; 7,5; 10; 15; i 20m (zależnie od rzeczywistej głębokości stacji pomiarowej). Przy głębokościach przydennych różniących się mniej niż 2,5m od założonej głębokości standardowej, zostanie pobrana tylko próba z głębokości przydennej. Natomiast przy głębokościach różniących się o 2,5m oraz ponad od założonej głębokości standardowej, pobrana zostanie dodatkowa próba z warstwy przydennej. Pobór próby przydennej zostanie wykonany na głębokości około 1m nad dnem, zależnie od panujących warunków hydrometeorologicznych determinujących możliwość poboru takiej próby. Zintegrowane w ten sposób próby w warstwie 0-10 m i 10-20 m zostaną zakonserwowane kwaśnym płynem Lugola, przy użyciu 1 ml płynu na 200 ml próby. Zakonserwowane próby będą przechowywane w ciemnym i chłodnym miejscu i dokonserwowywane w miarę rozkładania się płynu Lugola. Tak przechowywane próby nadają się do analizy ilościowej i jakościowej fitoplanktonu przez okres 1 roku. Do dokładniejszej analizy jakościowej fitoplanktonu pobrane będą dodatkowo próby za pomocą siatki planktonowej o rozmiarze oczka 10 μm. Pobór próbek fitoplanktonu siatką planktonową będzie wykonywany w warstwie podpowierzchniowej (zaciąg poziomy) lub w całym słupie wody (zaciąg pionowy), tj. od głębokości 1 m nad dnem do powierzchni. Również próby siatkowe będą konserwowane kwaśnym płynem Lugola.
Próby wody do analizy koncentracji chlorofilu a po pobraniu będą przechowywane w ciemnym i chłodnym miejscu bez dodatku substancji konserwujących i zostaną poddane filtracji na filtrach z włókna szklanego GF/F (retencja 0,7 μm) w laboratorium w możliwie najkrótszym czasie od pobrania. Filtry z osadem po wysuszeniu zostaną zamrożone w temperaturze -20°C i poddane dalszym procedurom analitycznym w terminie do 1 miesiąca.
W związku z tym, że analizie podlegać będzie zintegrowany słup wody morskiej do 20 m głębokości (cała strefa eufotyczna) obejmujący wszystkie organizmy, nawet te, które mają zdolność przemieszczania się w różnych porach doby na różne głębokości, nie ma szczególnych zaleceń co do pory dnia, w której powinny być zbierane próby.
Badania laboratoryjne fitoplanktonu zostaną przeprowadzone zgodnie ze standardami dotyczącymi badań ilościowych i jakościowych fitoplanktonu Morza Bałtyckiego (HELCOM). Poszczególne organizmy fitoplanktonowe będą oznaczane, liczone i mierzone przy użyciu mikroskopu odwróconego Olympus IX73 z zastosowaniem metody Utermöhla. Na podstawie pomiarów będą przyporządkowywane do odpowiednich klas wielkości. Następnie metodą geometryczną zostanie oszacowana średnia objętość komórek poszczególnych taksonów przez przypisanie ich odpowiednim figurom geometrycznym, takim jak: kula, cylinder, stożek itp.. Liczebność i biomasa fitoplanktonu oraz zawartość węgla w komórkach w litrze wody obliczane będą przy wykorzystaniu formuł obowiązujących dla monitoringu fitoplanktonu Morza Bałtyckiego HELCOM COMBINE.
Organizmy fitoplanktonowe zostaną oznaczone do możliwie najniższego poziomu taksonomicznego, a nazwy i systematyka zidentyfikowanych taksonów podane zostaną zgodnie z obowiązującą łacińską nomenklaturą Światowego Rejestru Gatunków Morskich (WoRMS, World Register of Marine Species). W sytuacjach, kiedy przy zastosowaniu metody Utermöhla nie będzie można oznaczyć taksonu, analizom poddane zostaną próby jakościowe pochodzące z zaciągów siatką planktonową. Opisana powyżej metoda pobierania próbek fitoplanktonu oraz ich analiza laboratoryjna jest zgodna z wytycznymi Ramowej Dyrektywy Wodnej (Dz.U. UE L. 2000 Nr 327, s. 1 z późn. zm.) i powstała w oparciu o procedury monitoringu fitoplanktonu Morza Bałtyckiego HELCOM COMBINE oraz zalecenia UNESCO. Przy oznaczaniu organizmów fitoplanktonowych, oprócz tradycyjnych kluczy, wykorzystywane będą informacje te ze stron internetowych.
Pomiary koncentracji chlorofilu a będą wykonane metodą fluorymetryczną zgodnie z procedurą zalecaną przez Komisję Helsińską dla Morza Bałtyckiego (HELCOM). W tym celu przygotowane filtry będą ekstrahowane etanolem przez 24 godziny w temperaturze pokojowej, a następnie odwirowane. Pomiar koncentracji chlorofilu a zostanie wykonany przy zastosowaniu fluorymetru Turner Design.
Metodyka badań zooplanktonu
Na każdej stacji zostanie pobrana jedna próbek zooplanktonu. Na 3 stacjach Zatoki Puckiej Zewnętrznej próby będą pobierane standardową siatką planktonową WP-2 o średnicy wloty 61 cm i siatce o boku oczka 100 µm. Będą wykonywane niestratyfikowane zaciągi pionowe od ok. 4 m nad dnem (długość siatki), do powierzchni. Na dwóch stacjach na Zatoce Puckiej Wewnętrznej, ze względu na głębokość (3-6 m) nie ma możliwości zastosowania siatki WP-2. W związku z tym, przy pomocy pompy zanurzeniowej, z całego słupa wody zostanie pobrana próba 40-80 l wody, która następnie będzie przefiltrowana przez siatkę o boku oczka 100 µm. Pobrane próby będą konserwowane w 4% roztworze buforowanego formaldehydu.
Następnie w laboratorium zostanie wykonane oznaczenie zgodne z zasadami HELCOM (Anex C-7/Guidelines for monitoring of mesozooplankton). Próba dzielona będzie za pomocą splittera na podpróby. Od gęstości próby zależy, ile podpróbek zostanie przeanalizowanych. Otrzymane liczebności przyporządkowane zostaną do ich klas wielkości i liczby biomasy z uwzględnieniem objętości przefiltrowanej wody.
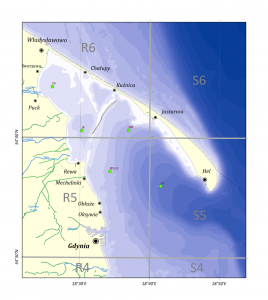
Orientacyjne rozmieszczenie stacji badawczych


